| Issue |
Matériaux & Techniques
Volume 105, Number 4, 2017
|
|
|---|---|---|
| Article Number | 403 | |
| Number of page(s) | 20 | |
| Section | Vieillissement et durabilité / Ageing and durability | |
| DOI | https://doi.org/10.1051/mattech/2018007 | |
| Published online | 19 March 2018 | |
Regular Article
Analyse de la dégradation thermique du Poly(éther éther cétone)
Analytical study of the thermal degradation of poly(ether ether ketone)
1
SAFRAN Composites,
33 avenue de la Gare,
97601
Itteville, France
2
Laboratoire PIMM, Arts et Métiers ParisTech,
151 boulevard de l’Hôpital,
75013
Paris, France
* e-mail: xavier.colin@ensam.eu
Reçu :
29
Août
2017
Accepté :
19
Janvier
2018
La dégradation thermique du PEEK a été étudiée à l’état caoutchoutique dans de larges intervalles de température (entre 180 et 320 °C) et de pression partielle d’oxygène (entre 0,21 et 50 bars). Tout d’abord, les mécanismes de vieillissement thermique ont été analysés et élucidés par spectroscopie IRTF et par calorimétrie différentielle (DSC) sur des films de PEEK suffisamment minces (entre 10 et 60 μm d’épaisseur) pour s’affranchir totalement des effets de la diffusion d’oxygène. L’oxydation se produit sur les cycles aromatiques provoquant la croissance de cinq nouvelles bandes d’absorption IR centrées à 3650, 3525, 1780, 1740 et 1718 cm-1 et attribuées aux vibrations d’élongation des liaisons O–H du phénol et de l’acide benzoïque, et des liaisons C–O de l’anhydride benzoïque, du benzoate de phényle et de la fluorénone respectivement. De plus, l’oxydation conduit à une large prédominance de la réticulation sur les coupures de chaîne (augmentation de Tg) empêchant le recuit du PEEK, en particulier lorsque la température d’exposition est supérieure au pied du pic de fusion. Enfin, les conséquences de l’oxydation sur les propriétés élastiques ont été analysées et élucidées par micro-indentation sur des sections droites préalablement polies de plaquettes de PEEK de 3 mm d’épaisseur. Les variations du module d’Young et du taux de cristallinité se corrèlent parfaitement, vérifiant ainsi la relation de Tobolsky.
Abstract
The thermal degradation of PEEK has been studied in rubbery state in wide ranges of temperature (between 180 and 320 °C) and oxygen partial pressure (between 0.21 and 50 bars). First of all, the thermal ageing mechanisms have been analysed and elucidated by FTIR spectroscopy and by differential scanning calorimetry (DSC) on sufficiently thin PEEK films (between 10 and 60 μm thickness) to be totally free of the effects of oxygen diffusion. Oxidation occurs on aromatic rings causing the growth of five new IR absorption bands centered at 3650, 3525, 1780, 1740 and 1718 cm-1 and attributed to the stretching vibrations of the O–H bonds of phenol and benzoïc acid, and the C–O bonds of benzoïc anhydride, phenyl benzoate and fluorenone respectively. In addition, oxidation leads to a large predominance of crosslinking over chain scissions (increase in Tg) preventing the annealing of PEEK, in particular when the temperature of exposure is higher than the onset of the melting endotherm. Finally, the consequences of oxidation on the elastic properties have been analysed and elucidated by micro-indentation on preliminarily polished cross-sections of PEEK plates of 3 mm thickness. The changes in Young’s modulus and crystallinity ratio correlate perfectly, thus checking the Tobolsky’s relationship.
Mots clés : PEEK / thermo-oxydation / coupures de chaîne / réticulation / module d’Young
Key words: PEEK / thermal oxidation / chain scissions / crosslinking / Young’s modulus
© EDP Sciences, 2018
 Open Access article, published by EDP Sciences, under the terms of the Creative Commons Attribution License (http://creativecommons.org/licenses/by/4.0), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Open Access article, published by EDP Sciences, under the terms of the Creative Commons Attribution License (http://creativecommons.org/licenses/by/4.0), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
1 Introduction
La compétition sur le marché aéronautique dépend d’enjeux à la fois économiques et écologiques tels que la réduction des coûts, de la masse embarquée et de la consommation de carburant. C’est pourquoi, depuis son origine, l’industrie aéronautique est à la recherche de nouveaux matériaux plus légers aux propriétés thermomécaniques élevées. Dans ce contexte, l’emploi de matériaux composites constitués de matrice organique renforcée par des fibres de verre ou de carbone (CMO) n’a cessé de progresser dans le but de remplacer peu à peu les matériaux métalliques. D’abord conçus pour la fabrication de pièces de structure (ailes, queue, fuselage, etc.), les CMO sont maintenant envisagés pour des applications dans des environnements thermochimiques de plus en plus sévères, comme les zones proches des sources de chaleur (environnements de moteur d’avion). Cependant, ils ne pourront être utilisés que si leur durabilité à long terme est clairement démontrée. L’utilisation de matrices thermoplastiques présente plusieurs avantages, comme l’intégration de fonction ou encore l’assemblage de pièces de même nature ou de natures différentes. Parmi les matrices thermoplastiques pouvant répondre au cahier des charges, le poly(éther éther cétone) (PEEK) apparaît comme un sérieux candidat. Il s’agit d’un polymère semi-cristallin de structure aromatique lui confèrant à la fois de hautes performances thermomécaniques (Tg ≈ 153 °C et Tf ≈ 343 °C) et une grande résistance chimique à la plupart des solvants usuels (acétone, toluène, acétate d’éthyle, etc.) et aux fluides aéronautiques (en particulier, le Skydrol). La dégradation thermique du PEEK a été étudiée sous atmosphère inerte ou faiblement oxygénée (typiquement dans l’air) surtout à l’état fondu (entre 340 et 485 °C), mais rarement à l’état caoutchoutique (entre 300 et 320 °C) et jamais, à notre connaissance, à l’état vitreux.
L’oxydation du PEEK se produit sur les seuls groupes hydrocarbonés de l’unité monomère, c’est-à-dire sur les cycles aromatiques, malgré la très faible labilité des atomes d’H. En effet, l’énergie de dissociation de la liaison C–H aromatique est de l’ordre de 465 kJ.mol-1, contre 393 et 378 kJ.mol-1 pour les liaisons C–H méthylénique et méthynique respectivement [1]. Au-delà de 400 °C, l’oxydation serait principalement amorcée par la rupture des liaisons éther et cétone de l’unité monomère [2–4]. Elle conduit à la disparition des groupes cétone (à 1653 cm-1), mais aussi à la formation d’une grande variété de produits de dégradation détectés par spectroscopie IRTF. Il s’agit notamment de produits macromoléculaires comme les phénols (entre 3400 et 3700 cm-1), le benzoate de phényle (à 1739 cm-1) et la fluorénone (1711 cm-1) [2–4], mais aussi de nombreux composés volatils [4–6]. Difficilement détectables en dessous de 430 °C, ces derniers ont été mis clairement en évidence au-dessus de 450 °C par analyse gravimétrique couplée à la chromatographie en phase gazeuse (ATG-CPG) ou à la spectrométrie de masse (ATG-SM). Il s’agit de quinones, de phénols, du monoxyde et du dioxyde de carbone, du benzène, mais aussi d’éthers et de cétones aromatiques [4,6].
Des mécanismes impliquant le réarrangement des radicaux phénoxyle et acyle, issus de la rupture des liaisons éther et cétone respectivement, ont été proposés pour expliquer la formation de la plupart des produits de dégradation. Cependant, ces mécanismes purement thermolytiques ne permettent pas d’expliquer l’accélération de la cinétique d’oxydation avec l’élévation de la pression partielle d’oxygène. Entre 360 et 460 °C, une seconde importante source de radicaux, pouvant elle aussi expliquer l’accumulation de plusieurs produits de dégradation, serait la décomposition unimoléculaire des hydroperoxydes [7].
Des modifications de l’architecture macromoléculaire du PEEK ont aussi été détectées par chromatographie d’exclusion stérique (CES ou CPG) [5], et par viscosimétrie en solution [3] ou à l’état fondu [5,7,8]. Entre 300 et 485 °C, la réticulation prédomine largement sur les coupures de chaîne, cette prédominance relative étant amplifiée à plus forte pression partielle d’oxygène. La réticulation se traduit par une augmentation de la masse moléculaire [3,5,7,8], de la fraction de gel [3,4] et de la température de transition vitreuse [5,8,9]. Le mécanisme de réticulation le plus probable est la recombinaison bimoléculaire des radicaux phényle [3–6].
Enfin, des modifications de la morphologie cristalline du PEEK ont été mises en évidence par analyse calorimétrique (DSC). Entre 380 et 440 °C, la réticulation limite la cristallisation quand le PEEK est refroidi à température ambiante depuis son état fondu, ce qui se traduit par une diminution de son point de fusion et de son taux de cristallinité [5,8,9].
Cet article présente une analyse à la fois multi-échelles et multi-techniques de la dégradation thermique du PEEK à des températures plus basses et des pressions partielles d’oxygène plus fortes que celles étudiées jusqu’à présent dans la littérature. Une attention particulière est portée aux conséquences de la dégradation sur deux propriétés thermomécaniques clés en aéronautique : la température de transition vitreuse et le module d’Young.
2 Matériaux et techniques
Le matériau d’étude est le PEEK 150G fourni par la société Victrex sous forme de granulés. Des plaques de 3 mm d’épaisseur ont été injectées au Pôle Européen de Plasturgie (PEP) d’Oyonnax à partir de ces granulés. Ces plaques ont été ensuite découpées au microtome LEICA RM2255 pour obtenir des films suffisamment minces (typiquement entre 10 et 60 µm d’épaisseur) garantissant une oxydation homogène dans toute l’épaisseur. La cinétique d’oxydation du PEEK a été étudiée à l’état caoutchoutique à 180, 200, 220, 250, 280, 300 et 320 °C sous des pressions partielles d’oxygène comprises entre 0,21 bar (dans des étuves à ventilation d’air forcée, régulées à ± 1 °C) et 50 bars (dans des autoclaves). Compte tenu du fort impact de la pression partielle d’oxygène sur la cinétique d’oxydation, les vieillissements aux températures les plus hautes (typiquement entre 280 et 320 °C) ont été menés sous 0,21 bar d’oxygène, alors que ceux aux températures les plus basses (entre 180 et 250 °C) ont dû être réalisés au-dessus de 1 bar d’oxygène pour pouvoir détecter des changements structuraux significatifs sur des durées d’étude compatibles avec la durée d’un travail de thèse (de quelques années). Tous les films ont été périodiquement sortis des enceintes de vieillissement et refroidis à température ambiante dans un dessiccateur contenant du silica-gel pour éviter une reprise en humidité avant d’être caractérisés. À noter que des échantillons plus épais (plaquettes de 3 mm d’épaisseur) ont aussi été exposés à 280 et 300 °C dans des étuves ventilées pour mettre en évidence des profils d’oxydation. Dans tous les cas, les conséquences de l’oxydation ont été analysées par plusieurs techniques complémentaires depuis l’échelle moléculaire jusqu’à l’échelle macroscopique, en passant par les échelles macromoléculaire, morphologique et microscopique.
Les modifications de la structure moléculaire ont été suivies par spectroscopie IRTF en mode transmission. Les spectres IRTF des films de PEEK ont été mesurés avant et après vieillissement afin de pouvoir détecter et quantifier non seulement la disparition des groupes chimiques initialement présents dans la matrice PEEK, mais aussi la formation des principaux produits d’oxydation. Les analyses ont été réalisées à l’aide d’un appareil Frontier de chez Perkin Elmer dans un domaine spectral s’étendant de 400 à 4000 cm-1, après avoir moyenné les 16 enregistrements obtenus avec une résolution minimale de 4 cm-1. Le vieillissement thermique du PEEK conduit à deux principales modifications du spectre IRTF (Fig. 1). Tout d’abord, dans la zone des hydroxyles entre 3400 et 3700 cm-1, on note l’apparition et la croissance de deux bandes d’absorption IR centrées à 3600 et 3525 cm-1. Elles sont respectivement attribuées aux vibrations d’élongation des liaisons O–H des phénols et de tous les autres types de produits hydroxyles, majoritairement l’acide benzoïque [2,10]. Ensuite, dans la zone des carbonyles entre 1700 et 1800 cm-1, on observe l’apparition et la croissance de trois bandes d’absorption IR centrées à 1780, 1740 et 1718 cm-1. Elles sont respectivement attribuées aux vibrations d’élongation des liaisons C–O de l’anhydride benzoïque, du benzoate de phényle et de la fluorénone [2,10,11].
Rappelons que la concentration C des différents produits de dégradation est liée à l’absorbance Abs de leur bande IR par la loi de Beer-Lambert :
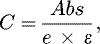 (1)
où e est l’épaisseur de l’échantillon (cm) et ε le coefficient d’extinction molaire dont les valeurs moyennes sont accessibles dans la littérature : ε (O–H des phénols et acides) = 90 L.mol-1.cm-1 [12,13], ε (C = O des anhydrides et cétones) = 300 L.mol-1.cm-1 [14] et ε (C = O des esters) = 550 L.mol-1.cm-1 [15].
(1)
où e est l’épaisseur de l’échantillon (cm) et ε le coefficient d’extinction molaire dont les valeurs moyennes sont accessibles dans la littérature : ε (O–H des phénols et acides) = 90 L.mol-1.cm-1 [12,13], ε (C = O des anhydrides et cétones) = 300 L.mol-1.cm-1 [14] et ε (C = O des esters) = 550 L.mol-1.cm-1 [15].
Signalons que, en raison du chevauchement des bandes d’absorption IR dans la région des carbonyles, il a été nécessaire de réaliser une déconvolution mathématique basée sur des fonctions gaussiennes à l’aide du logiciel OriginLab pour pouvoir extraire les contributions élémentaires des différents groupes carbonyle (Fig. 2). En plus des trois bandes précedentes, cette déconvolution a mis en évidence une quatrième contribution vers 1790 cm-1. Cependant, comme son absorbance est extrêment faible et n’évolue pas pendant le vieillissement thermique, cette dernière bande a été logiquement négligée par la suite.
Les conséquences de l’oxydation sur l’architecture macromoléculaire et la morphologie cristalline ont été suivies par analyse calorimétrique (DSC). Les thermogrammes DSC des films de PEEK ont été mesurés avant et après vieillissement afin d’accéder aux évolutions de la température de transition vitreuse (Tg), du point de fusion (Tf) et de l’enthalpie de fusion (ΔHf). Les analyses ont été effectuées à l’aide d’un calorimètre Q1000 de chez TA Instruments entre 25 et 300 °C avec une vitesse de chauffe de 10 °C.min-1 sous flux d’azote. Les valeurs de Tg et Tf ont été prises au point d’inflexion de la courbe de variation du flux de chaleur avec la température et au sommet du pic endothermique respectivement. La valeur de ΔHf correspond à l’aire sous le pic endothermique.
Le taux de cristallinité a été déterminé à l’aide de la relation suivante :
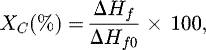 (2)
où ΔHf0 est l’enthalpie de fusion du cristal : ΔHf0 = 130 J.g-1 pour le PEEK [16].L’épaisseur des lamelles cristallines a été déterminée à l’aide de la relation de Gibbs-Thomson :
(2)
où ΔHf0 est l’enthalpie de fusion du cristal : ΔHf0 = 130 J.g-1 pour le PEEK [16].L’épaisseur des lamelles cristallines a été déterminée à l’aide de la relation de Gibbs-Thomson :
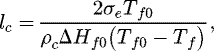 (3)où σe est l’énergie libre de surface à l’interface phase amorphe/phase cristalline, ρC est la densité de la phase cristalline et Tf0 est le point de fusion du cristal parfait : σe = 4,9 × 10-2 J.m-2, ρC = 1400 kg.m-3 et Tf0 = 668 K pour le PEEK [16].
(3)où σe est l’énergie libre de surface à l’interface phase amorphe/phase cristalline, ρC est la densité de la phase cristalline et Tf0 est le point de fusion du cristal parfait : σe = 4,9 × 10-2 J.m-2, ρC = 1400 kg.m-3 et Tf0 = 668 K pour le PEEK [16].
Enfin, l’impact du vieillissement sur les propriétés élastiques (principalement sur le module d’Young) a été déterminé par des essais de micro-indentation sur les sections droites préalablement polies des plaquettes de 3 mm d’épaisseur. Les plaquettes ont été découpées suivant leur épaisseur et enrobées à froid dans une résine acrylique commerciale KM-V, qui a ensuite été réticulée pendant 12 h sous vide primaire à température ambiante. Les sections droites ont été polies à l’aide d’une polisseuse MECAPOL P320 en utilisant tout d’abord, une série de papiers abrasifs en particules de carbure de silicium et de taille décroissante (typiquement de granulométrie 80 à 2400). Enfin, une finition miroir a été obtenue à l’aide de pâtes de particules de diamant de taille décroissante (typiquement de 3 à 0,25 µm). Les indentations ont ensuite été réalisées à l’aide du Micro Indentation Tester (MHT) de chez CSM Instrument équipé d’une pointe en diamant de type Vickers de géométrie pyramidale avec une force de 500 mN, et des vitesses de charge et décharge de 1000 µm.min-1. Une pause de 5 secondes a été systématiquement appliquée entre la charge et la décharge. Le logiciel d’exploitation Indentation 4.37 donne directement accès à la valeur du module réduit du matériau (Er) qui est calculée selon la méthode d’Oliver and Pharr [17–19] :
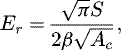 (4)
où S est la pente initiale de la courbe de décharge, β est un facteur de forme dépendant du type d’indenteur (β = 1,012 dans le cas d’un indenteur de type Vickers) et Ac est l’aire de contact projetée. Cette dernière grandeur est directement donnée par le logiciel d’exploitation. Elle dépend de la profondeur de contact de l’indenteur sur l’échantillon et de la géométrie de l’indenteur.
(4)
où S est la pente initiale de la courbe de décharge, β est un facteur de forme dépendant du type d’indenteur (β = 1,012 dans le cas d’un indenteur de type Vickers) et Ac est l’aire de contact projetée. Cette dernière grandeur est directement donnée par le logiciel d’exploitation. Elle dépend de la profondeur de contact de l’indenteur sur l’échantillon et de la géométrie de l’indenteur.
Le module élastique local a été déterminé à partir du module réduit à l’aide de la relation suivante :
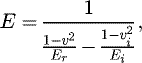 (5)
où ν est le coefficient de Poisson du PEEK vierge égal à 0,4 (donnée fournisseur), et νi et Ei sont le coefficient de Poisson et le module d’Young de l’indenteur en diamant, respectivement égaux à 0,07 et 1141 GPa.
(5)
où ν est le coefficient de Poisson du PEEK vierge égal à 0,4 (donnée fournisseur), et νi et Ei sont le coefficient de Poisson et le module d’Young de l’indenteur en diamant, respectivement égaux à 0,07 et 1141 GPa.
Le module élastique global EEchant de l’échantillon a ensuite été déduit des N valeurs locales E(j) composant le profil de micro-indentation à l’aide de la relation suivante :
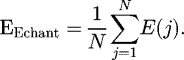 (6)
(6)
Dans cette étude, EEchant a été assimilé au module d’Young de l’échantillon après avoir vérifié, par traction uniaxiale, qu’il donne une très bonne estimation de ce dernier. En effet, il a été trouvé que leurs valeurs respectives ne diffèrent que d’un facteur 0,84.
 |
Fig. 1 Modification des régions des liaisons C ═ O (a) et O–H (b) du spectre IRTF du PEEK au cours de son vieillissement thermique dans l’air à 300 °C. Changes in the regions of C ═ O (a) and O–H bonds (b) in the FTIR spectrum of PEEK during its thermal ageing in air at 300 °C. |
 |
Fig. 2 Déconvolution de la région des liaisons C ═ O du spectre IR du PEEK après 324 h d’exposition à 300 °C sous 0,21 bar d’oxygène (a) et après 196 h d’exposition à 250 °C sous 10 bars d’oxygène (b). Deconvolution of the region of C ═ O bonds in the IR spectrum of PEEK after 324 h of exposure at 300 °C under 0.21 bar of oxygen (a) and after 196 h of exposure at 250 °C under 10 bars of oxygen (b). |
3 Résultats et discussion
3.1 Modifications de la structure moléculaire
À titre d’exemple, les figures 3 et 4 rapportent l’évolution des concentrations des différents produits carbonyle : l’anhydride benzoïque (à 1780 cm-1), le benzoate de phényle (1740 cm-1) et la fluorénone (1718 cm-1), ainsi que des différents produits hydroxyle : les phénols (3650 cm-1) et l’acide benzoïque (3525 cm-1), au cours du vieillissement thermique du PEEK dans l’air entre 250 et 320 °C. Comme attendu, la température accélère la cinétique d’oxydation du PEEK.
Deux indicateurs de vieillissement ont été déterminés graphiquement pour l’ensemble des courbes cinétiques. Il s’agit du temps d’induction (ti) marquant le début de la phase d’auto-accélération, et de la vitesse maximale d’oxydation (rox) correspondant à la pente maximale des courbes cinétiques. Ces deux indicateurs obéissent à une loi d’Arrhenius entre 250 et 320 °C. Malgré la dispersion des résultats, les énergies d’activation de ti et rox sont du même ordre de grandeur pour l’ensemble des produits de dégradation. À titre d’exemple, le tableau 1 récapitule les valeurs d’énergie d’activation trouvées dans l’air. Les valeurs moyennes, qui caractérisent la cinétique d’oxydation du PEEK dans ces conditions d’exposition, sont : 113 ± 21 kJ.mol-1 pour ti, et 160 ± 17 kJ.mol-1 pour rox.
Les vitesses maximales d’accumulation du benzoate de phényle et de la fluorénone dans l’air à l’état fondu, typiquement entre 400 et 485 °C, ont déjà été déterminées dans la littérature [2]. Leurs valeurs sont rapportées dans le diagramme d’Arrhénius de la figure 5 où elles sont comparées aux vitesses déterminées pour ces deux produits dans l’air à l’état caoutchoutique (entre 250 et 320 °C dans cette étude). Deux comportements distincts sont clairement mis en évidence de part et d’autre du point de fusion (Tf ≈ 343 °C) du PEEK. À l’état caoutchoutique, les deux produits de dégradation s’accumulent avec des vitesses assez proches alors que, à l’état fondu, leurs vitesses d’accumulation diffèrent sensiblement, cet écart grandissant avec l’élévation de la température. En plus d’un saut du facteur pré-exponentiel, principalement dû à la transformation de la phase cristalline en phase amorphe, on observe clairement une rupture de pente dans le graphe d’Arrhenius de rox du benzoate de phényle au passage de Tf, alors que pour la fluorénone, la pente reste quasiment identique. Les énergies d’activation trouvées pour ces deux produits de dégradation de part et d’autre de Tf sont rapportées dans le tableau 2.
Une analyse plus attentive de la région des carbonyles montre une inversion dans les prédominances relatives des bandes d’absorption IR du benzoate de phényle (à 1740 cm-1) et de la fluorénone (1718 cm-1) au passage de Tf (Fig. 6). Dans leur étude, Cole et Casella [2] avaient déjà montré une prédominance du benzoate de phényle sur la fluorénone à 400 °C et le comportement inverse à plus haute température (typiquement entre 430 et 485 °C). Pour expliquer cette inversion de comportement, ils avaient avancé l’hypothèse d’un contrôle de l’oxydation par la diffusion d’oxygène dans des films de PEEK de 50 µm d’épaisseur à partir de 430 °C. En revanche, à 400 °C, l’oxydation serait suffisamment lente pour permettre à l’oxygène de diffuser jusqu’au cœur des films. Le benzoate de phényle, qui est formé uniquement en présence d’oxygène, serait alors présent dans toute l’épaisseur des films et de ce fait, deviendrait le produit de dégradation majoritaire. Cependant, cette hypothèse ne permet pas d’expliquer la totale disparition du benzoate de phényle au-dessus du Tf.
Or, on sait que certaines réactions chimiques, en particulier les recombinaisons des espèces radicalaires, sont favorisées par l’augmentation de la mobilité moléculaire au passage d’une transition physique. Malheureusement, la littérature ne propose pas de mécanisme de formation du benzoate de phényle. Une possibilité, pourtant, serait la terminaison par couplage des radicaux carboxyle et phénoxyle (Fig. 7) dont les origines seront détaillées plus loin dans ce document. Cette réaction nécessite le réarrangement du radical phényle sous une forme quinonique. Bien entendu, elle est en compétition avec la diffusion de ces deux radicaux hors de la cage, qui va conduire à la formation d’une grande variété de produits de dégradation (acide benzoïque, dioxyde de carbone, phénols, etc.). On s’attend à ce que l’élévation de la température favorise la diffusion et ainsi, réduise sensiblement le rendement de formation du benzotate de phényle, comme précédemment observé sur la figure 5.
Pour mettre en évidence l’effet de la pression partielle d’oxygène sur la cinétique d’oxydation du PEEK, des analyses IRTF ont été réalisées sur des films vieillis sous des pressions partielles d’oxygène comprises entre 0,21 (dans l’air) et 50 bars entre 180 et 250 °C. À titre d’exemple, les figures 8 et 9 rapportent l’évolution des concentrations des différents produits carbonyle (anhydride benzoïque, benzoate de phényle et fluorénone) et hydroxyle (phénols et acide benzoïque) au cours du vieillissement thermique du PEEK sous différentes pressions partielles d’oxygène à 250 °C. Il apparaît clairement que la pression partielle d’oxygène accélère la cinétique d’oxydation du PEEK. L’anhydride benzoïque et le benzoate de phényle sont les deux produits de dégradation majoritaires sous forte pression partielle d’oxygène. Par contre, les phénols et l’acide benzoïque se forment en très faible concentration, quelle que soit la pression partielle d’oxygène.
À titre d’exemple, les valeurs de ti et rox déterminées pour l’anhydride benzoïque, le benzoate de phényle et la fluorénone à 250 °C ont été portées en fonction de la pression partielle d’oxygène sur la figure 10. Si les valeurs de ti sont comparables, en revanche, les valeurs de rox se rangent dans l’ordre d’importance des produits carbonyle rapporté précédemment (Fig. 8), à savoir :
benzoate de phényle > anhydride benzoïque >> fluorénone
On constate que les courbes présentent une allure hyperbolique et atteignent un plateau de saturation qui est caractéristique du régime en excès d’oxygène à forte pression partielle d’oxygène. En d’autres termes, ti et rox deviennent presque indépendants de la pression partielle d’oxygène au-dessus d’une valeur critique, notée Pc.
Les valeurs de Pc, ainsi que les valeurs de ti et rox en excès d’oxygène, déterminées à 220 et 250 °C sont récapitulées au tableau 3. Notons que l’excès d’oxygène n’est pas encore atteint sous 50 bars d’oxygène à 180 et 200 °C. Néanmoins, il apparaît clairement que Pc est une fonction décroissante de la température. Ainsi, entre 180 et 250 °C, tous les vieillissements effectués dans l’air correspondent à un régime en défaut d’oxygène.
L’ensemble de ces résultats expérimentaux permet de proposer un mécanisme de dégradation thermique du PEEK. Comme déjà proposé dans la littérature [2–4], ce mécanisme est amorcé par la rupture des liaisons cétone et éther de l’unité monomère et ainsi, conduit à la formation de trois principaux types d’espèce radicalaire (Fig. 11) : acyle (P1●), phénoxyle (P2●) et phényle (P3● ou P4●). Tout d’abord, les radicaux acyles sont à l’origine de la formation du monoxyde de carbone (CO) par décarbonylation, et du benzaldéhyde par arrachement d’hydrogène sur les cycles aromatiques. En raison de la faible énergie de dissociation de la liaison C–H dans un groupe aldéhyde (ED = 375 kJ.mol-1 [20], contre ED = 393 kJ.mol-1 dans un groupe méthylène), on s’attend à ce que le benzaldéhyde s’oxyde quasi-instantanément en acide benzoïque. Il n’est donc pas étonnant que ce produit carbonyle ne soit pas détecté par spectoscopie IRTF [21]. En revanche, les radicaux phénoxyle conduisent à la formation de phénols par arrachement d’hydrogène sur les cycles aromatiques. Comme les stabilisants phénoliques [22], ils peuvent aussi être stabilisés par résonance et entraîner la formation d’espèces quinoniques.
Ainsi, la propagation de l’oxydation s’effectue en deux étapes. D’abord, la formation de radicaux peroxy par addition d’oxygène sur les radicaux acyle et phényle. Ensuite, la formation d’hydroperoxydes (POOH) par arrachement d’hydrogène sur les cycles aromatiques par les radicaux peroxy (Fig. 12). Rappelons que, à haute température (typiquement pour T > 200 °C), la décomposition des hydroperoxydes est exclusivement unimoléculaire [23].
Les hydroperoxydes issus de l’oxydation des radicaux acyle sont à l’origine de la formation de l’acide benzoïque. En effet, leur décomposition génère des radicaux carbonyle qui peuvent soit se recombiner par arrachement d’hydrogène sur les cycles aromatiques et ainsi, donner l’acide benzoïque, soit se réarranger pour former du dioxyde de carbone (CO2) par décarboxylation (Fig. 13). Quant aux phénols, ils proviennent des radicaux phénoxyle générés par la thermolyse (Fig. 11), mais aussi par la décomposition des hydroperoxydes issus de l’oxydation des radicaux phényle (Fig. 14).
Comme déjà proposé dans la littérature [2,6], la réaction de terminaison par couplage intramoléculaire de radicaux phényle permet d’expliquer la formation de la fluorénone en défaut d’oxygène (Fig. 15). Cependant, ce produit de dégradation est également présent, bien qu’en plus faible quantité, sous forte pression partielle d’oxygène. Une seconde réaction de terminaison, par couplage intramoléculaire de radicaux peroxy a donc été proposée dans cette étude pour rendre compte de ce comportement (Fig. 16).
 |
Fig. 3 Évolution des concentrations en anhydride benzoïque (a), benzoate de phényle (b) et fluorénone (c) au cours du vieillissement thermique du PEEK dans l’air à 250 (en vert), 280 (orange), 300 (rouge) et 320 °C (bleu). Changes in the concentrations of benzoic anhydride (a), phenyl benzoate (b) and fluorenone (c) during the thermal ageing of PEEK in air at 250 (in green), 280 (orange), 300 (red) and 320 °C (blue). |
 |
Fig. 4 Évolution des concentrations en phénols (a) et acide benzoïque (b) au cours du vieillissement thermique du PEEK dans l’air à 250 (en vert), 280 (orange), 300 (rouge) et 320 °C (bleu). Changes in the concentrations of phenols (a) and benzoic acid (b) during the thermal ageing of PEEK in air at 250 (in green), 280 (orange), 300 (red) and 320 °C (blue). |
Énergie d’activation des temps d’induction (ti) et des vitesses maximales (rox) de formation de l’anhydride benzoïque, du benzoate de phényle, de la fluorénone, des phénols et de l’acide benzoïque dans l’air entre 250 et 320 °C.
Activation energy of the induction times (ti) and the maximum rates (rox) of the formation of benzoic anhydride, phenyl benzoate, fluorenone, phenols and benzoic acid in air between 250 and 320 °C.
 |
Fig. 5 Graphe d’Arrhenius des vitesse maximales (rox) de formation du benzoate de phényle (en bleu) et de la fluorénone (vert) dans l’air entre 250 et 485 °C. Les résultats de cette étude (entre 250 et 320 °C) sont en symboles pleins alors que ceux de la littérature (entre 400 et 485 °C [2]) sont en symboles vides. Arrhenius diagram of the maximum rates (rox) of the formation of phenyl benzoate (in blue) and fluorenone (green) in air between 250 and 485 °C. The results of the present study (between 250 and 320 °C) are given in full symbols whereas those of the literature (between 400 and 485 °C [2]) are given in empty symbols. |
Énergie d’activation des vitesses maximales (rox) de formation du benzoate de phényle et de la fluorénone dans l’air à l’état caoutchoutique entre 250 et 320 °C (cette étude) et à l’état fondu entre 400 et 485 °C (littérature [2]).
Activation energy of the maximum rates (rox) of the formation of phenyl benzoate and fluorenone in air in rubbery state between 250 and 320 °C (present study) and in molten state between 400 and 485 °C (literature [2]).
 |
Fig. 6 Prédominance relative des bandes d’absorption IR du benzoate de phényle (à 1740 cm-1) et de la fluorénone (1718 cm-1) au cours du vieillissement thermique du PEEK dans l’air à l’état caoutchoutique entre 250 et 320 °C (cette étude) et à l’état fondu entre 400 et 485 °C (littérature [2]). Relative predominance of the IR absorption bands of phenyl benzoate (at 1740 cm-1) and fluorenone (1718 cm-1) during the thermal ageing of PEEK in air in rubbery state between 250 and 320 °C (present study) and in molten state between 400 and 485 °C (literature [2]). |
 |
Fig. 7 Mécanisme de formation du benzoate de phényle par couplage des radicaux carboxyle et phénoxyle. Formation mechanism of phenyl benzoate by coupling carboxyl and phenoxyl radicals. |
 |
Fig. 8 Évolution des concentrations en anhydride benzoïque (a), benzoate de phényle (b) et fluorénone (c) au cours du vieillissement thermique du PEEK sous une pression de 0,21 bar (en vert), 3 bars (rouge), 6 bars (violet), 8 bars (noir) et 10 bars d’oxygène (bleu) à 250 °C. Changes in the concentrations of benzoic anhydride (a), phenyl benzoate (b) and fluorenone (c) during the thermal ageing of PEEK under an oxygen pressure of 0.21 bar (in green), 3 bars (red), 6 bars (violet), 8 bars (black) and 10 bars (blue) at 250 °C. |
 |
Fig. 9 Évolution des concentrations en phénols (a) et acide benzoïque (b) au cours du vieillissement thermique du PEEK sous une pression de 0,21 bar (en vert), 3 bars (rouge), 6 bars (violet), 8 bars (noir) et 10 bars d’oxygène (bleu) à 250 °C. Changes in the concentrations of phenols (a) and benzoic acid (b) during the thermal ageing of PEEK under an oxygen pressure of 0.21 bar (in green), 3 bars (red), 6 bars (violet), 8 bars (black) and 10 bars (blue) at 250 °C. |
 |
Fig. 10 Variation des temps d’induction (a) et des vitesses maximales (b) de formation de l’anhydride benzoïque ( Changes of the induction times (a) and the maximum rates (b) of the formation of benzoic anhydride ( |
Pression critique (Pc), temps d’induction (ti) et vitesse maximale (rox) de formation de l’anhydride benzoïque, du benzoate de phényle et de la fluorénone en excès d’oxygène à 220 et 250 °C.
Critical pressure (PC), induction time (ti) and maximum rate (rox) of the formation of benzoic anhydride, phenyl benzoate and fluorenone in oxygen excess at 220 and 250 °C.
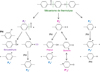 |
Fig. 11 Amorçage de la dégradation thermique du PEEK par rupture thermolytique de liaisons cétone et éther de la chaîne macromoléculaire. Formation de plusieurs espèces radicalaires notées : P1●, P2●, P3● et P4●. Initiation of the thermal degradation of PEEK by thermolytic breakdown of ketone and ether bonds of the macromolecular chain. Formation of several radical species denoted: P1●, P2●, P3● and P4●. |
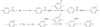 |
Fig. 12 Addition d’oxygène sur les radicaux acyle et phényle suivie de la formation d’hydroperoxydes par arrachement d’hydrogène sur les cycles aromatiques. Oxygen addition onto acyl and phenyl radicals followed by the formation of hydroperoxides by hydrogen abstraction on aromatic rings. |
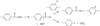 |
Fig. 13 Amorçage de la dégradation thermique par décomposition unimoléculaire de l’hydroperoxyde issu du radical acyle, entraînant la formation de l’acide benzoïque (en haut) ou une décarboxylation (en bas). Initiation of the thermal degradation by unimolecular decomposition of the hydroperoxide resulting from the acyl radical. Formation of benzoic acid (top) or decarboxylation (below). |
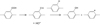 |
Fig. 14 Amorçage de la dégradation thermique par décomposition unimoléculaire de l’hydroperoxyde issu du radical phényle. Formation d’un phénol. Initiation of the thermal degradation by unimolecular decomposition of the hydroperoxide resulting from the phenyl radical. Formation of phenol. |
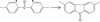 |
Fig. 15 Mécanisme de formation de la fluorénone par couplage intramoléculaire des radicaux phényle. Formation mechanism of fluorenone by intramolecular coupling of phenyl radicals. |
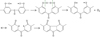 |
Fig. 16 Mécanisme de formation de la fluorénone par couplage intramoléculaire de radicaux peroxy. Formation mechanism of fluorenone by intramolecular coupling of peroxy radicals. |
3.2 Modifications de la structure macromoléculaire
L’évolution des masses moléculaires pendant le vieillissement des polymères permet de mettre en évidence les modifications au niveau de l’architecture macromoléculaire, c’est-à-dire les coupures de chaîne (notées S) et les actes de réticulation (notés X). Comme chaque coupure de chaîne fait apparaître une nouvelle chaîne tandis que chaque acte de réticulation fait disparaître une chaîne, on peut écrire :
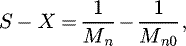 (7)
où Mn0 et Mn sont respectivement les masses moléculaires moyennes en nombre avant et après vieillissement.
(7)
où Mn0 et Mn sont respectivement les masses moléculaires moyennes en nombre avant et après vieillissement.
Cependant, il n’a pas été possible de suivre l’évolution de la masse moléculaire du PEEK pendant son vieillissement thermique par des méthodes d’analyse directes, de type chromatographique (CES ou CPG) ou viscosimétrique (en solution), car ce polymère n’est pas soluble dans les solvants usuels (acétone, toluène, acétate d’éthyle, etc.). Nous avons donc eu recours à la calorimétrie différentielle (DSC) qui donne accès de manière indirecte à la valeur de Mn connaissant la valeur de Tg via la relation de Fox-Flory [24]:
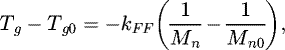 (8)
où kFF est la constante de Fox-Flory (exprimée en K.mol.kg-1) qui augmente avec la rigidité des chaînes.
(8)
où kFF est la constante de Fox-Flory (exprimée en K.mol.kg-1) qui augmente avec la rigidité des chaînes.
La valeur de kFF a été déterminée à partir des températures de transition vitreuse et des masses moléculaires de plusieurs grades de PEEK Victrex. En effet, la pente de la courbe Tg = f(1/Mn) donne accès à la valeur de kFF tandis que l’ordonnée à l’origine correspond à la valeur de Tg∞ (c’est-à-dire à la Tg théorique du polymère linéaire de même structure chimique mais de masse moléculaire infinie). Ainsi, pour le PEEK Victrex, on a trouvé : kFF = 204 K.kg.mol-1 et Tg∞ = 432 K. Notons que cette dernière valeur est très proche de la Tg∞ théorique (Tg∞ = 433 K) calculée à l’aide de la loi d’additivité molaire proposée par Van Krevelen dans son livre [25].
En combinant les équations (7) et (8), on obtient la relation suivante entre Tg et les nombres d’actes de coupure de chaîne et de réticulation :
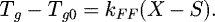 (9)
(9)
On voit que Tg diminue avec le nombre de coupures de chaîne, mais augmente avec le nombre d’actes de réticulation.
La figure 17 rapporte l’évolution des écarts entre la Tg et sa valeur initiale (Tg–Tg0), et entre les nombres d’actes de réticulation et de coupure de chaîne (X–S) des films de PEEK dans l’air entre 250 et 320 °C. Il apparaît clairement que la réticulation prédomine largement sur les coupures de chaîne à l’état caoutchoutique. Rappelons que cette prédominance relative avait déjà été observée par plusieurs auteurs à l’état fondu [3–5,7–9]. De plus, la réticulation est fortement thermo-activée.
Les valeurs du temps d’induction (ti) et la vitesse maximale de réticulation (rx) ont été déterminées graphiquement pour l’ensemble de ces courbes cinétiques. En première approche, les coupures de chaîne ont été négligées devant la réticulation, ce qui a permis de réécrire l’équation (9) sous la forme :
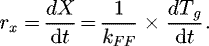 (10)
(10)
Ces deux indicateurs obéissent à une loi d’Arrhenius entre 250 et 320 °C. Les valeurs d’énergie d’activation sont rapportées au tableau 4 où elles sont comparées aux valeurs obtenues pour les produits carbonyle. Elles sont toutes du même ordre de grandeur.
Des analyses DSC ont également été réalisées sur des films de PEEK après vieillissement sous différentes pression partielle d’oxygène comprises entre 0,21 et 20 bars à 250 °C. Les évolutions de (Tg–Tg0) et de (X–S) sont données sur la figure 18. On retrouve les mêmes comportements que dans l’air. D’une manière générale, la pression partielle d’oxygène accélère la cinétique de réticulation jusqu’à une pression critique de l’ordre de 5 bars à 250 °C, qui avait déjà été déterminée par spectroscopie IRTF.
Les valeurs de ti et rx déterminées à 250 °C ont été portées en fonction de la pression partielle d’oxygène sur la figure 19. On constate que les courbes présentent une allure hyperbolique et atteignent un plateau caractéristique du régime d’excès d’oxygène à partir de Pc = 5 bars. Les valeurs de ti et rx en excès d’oxygène à 250 °C sont récapitulées au tableau 5 où elles sont comparées aux valeurs obtenues pour les produits carbonyle. Elles sont toutes du même ordre de grandeur. On en déduit que la réticulation est une conséquence directe de l’oxydation du PEEK.
Comme déjà proposé dans la littérature [3–6], la terminaison par couplage intermoléculaire des radicaux phényle est le principal mécanisme de réticulation en défaut d’oxygène (Fig. 20). Cependant, cette réaction ne peut pas expliquer la réticulation du PEEK en excès d’oxygène car, dans ces conditions d’exposition, tous les radicaux P● ont été quasi-instantanément transformés en radicaux PO2●.
Une possibilité serait la terminaison par couplage intermoléculaire des radicaux péroxy. En effet, cette réaction implique, tout d’abord, la formation d’un pont tétraoxyde (POOOOP) très instable, qui se décompose quasi-instantanément à haute température (en particulier, au-dessus de 150 °C) pour donner deux radicaux PO● et de l’oxygène. Cependant, les radicaux PO• peuvent se réarranger pour finalement se coupler et ainsi, former un nœud de réticulation, comme illustré sur la figure 21.
Il existe d’autres mécanismes de réticulation qui peuvent se produire dans tout le domaine de pressions partielles d’oxygène. Le mécanisme de formation du benzoate de phényle a déjà été mentionné dans la section 3.1 (Fig. 7). Cependant, dans ce cas, on n’obtient pas un noeud de réticulation tétrafonctionnel (en « X »), mais trifonctionnel (en « T »). On peut imaginer un autre mode de réarrangement du radical phénoxyle, impliquant la rupture d’une liaison cétone avant de se coupler avec le radical carboxyle pour donner, au final, l’anhydride benzoïque (Fig. 22). Cependant, dans ce cas, on n’obtient pas un nœud de réticulation, mais on reforme une chaîne macromoléculaire.
Ces deux mécanismes jouent certainement un rôle majeur à l’échelle macromoléculaire, comme en témoigne la figure 23. En effet, il existe clairement une corrélation entre les accumulations du benzoate de phényle et de l’anhydride benzoïque et l’augmentation de Tg. De plus, les vitesses d’accumulation de ces deux produits sont du même ordre de grandeur que la vitesse de réticulation.
 |
Fig. 17 Évolution des écarts entre la température de transition vitreuse et sa valeur initiale (Tg–Tg0) (a) et entre les nombres d’actes de réticulation et de coupure de chaîne (X–S) (b) au cours du vieillissement thermique du PEEK dans l’air à 250 (en vert), 280 (orange), 300 (rouge) et 320 °C (bleu). Changes in the gaps between the glass transition temperature and its initial value (Tg–Tg0) (a) and between the numbers of crosslinking and chain scission events (X–S) (b) during the thermal ageing of PEEK in air at 250 (in green), 280 (orange), 300 (red) and 320 °C (blue). |
Énergie d’activation du temps d’induction (ti) et de la vitesse maximale (r) des modifications moléculaires et macromoléculaires dans l’air entre 250 et 320 °C.
Activation energy of induction time (ti) and maximum rate (r) of molar and macromolecular modifications in air between 250 and 320 °C.
 |
Fig. 18 Évolution des écarts entre la température de transition vitreuse et sa valeur initiale (Tg–Tg0) (a) et entre le nombre d’actes de réticulation et de coupure de chaîne (X–S) (b) au cours du vieillissement thermique du PEEK sous une pression de 0,21 bar (en vert), 3 bars (rouge), 8 bars (noir), 10 bars (bleu) et 20 bars d’oxygène (orange) à 250 °C. Changes in the gaps between the glass transition temperature and its initial value (Tg–Tg0) (a) and the number of crosslinking and chain scission events (X–S) (b) during the thermal ageing of PEEK under an oxygen pressure of 0.21 bar (in green), 3 bars (red), 8 bars (black), 10 bars (blue) and 20 bars (orange) at 250 °C. |
 |
Fig. 19 Variation du temps d’induction (a) et de la vitesse maximale (b) de réticulation avec la pression partielle d’oxygène à 250 °C. Changes in the induction time (a) and the maximum rate (b) of crosslinking with oxygen partial pressure at 250 °C. |
Pression critique (Pc), temps d’induction (ti) et vitesse maximale (r) des modifications moléculaires et macromoléculaires en excès d’oxygène à 250 °C.
Critical pressure (PC), induction time (ti) and maximum rate (r) of molar and macromolecular modifications in oxygen excess at 250 °C.
 |
Fig. 20 Mécanisme de réticulation du PEEK par couplage intermoléculaire des radicaux phényle [3–6]. Crosslinking mechanism of PEEK by intermolecular coupling of phenyl radicals [3–6]. |
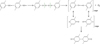 |
Fig. 21 Mécanisme de réticulation du PEEK par couplage intermoléculaire des radicaux péroxy. Crosslinking mechanism of PEEK by intermolecular coupling of peroxy radicals. |
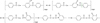 |
Fig. 22 Formation de l’anhydride benzoïque par couplage des radicaux carboxyle et phénoxyle. Formation of benzoic anhydride by coupling of carboxyl and phenoxyl radicals. |
 |
Fig. 23 Comparaison l’évolution des concentrations en anhydride benzoïque ( Comparison of the changes in the concentrations of benzoic anhydride ( |
3.3 Conséquences de l’oxydation sur les propriétés élastiques
Les profils de module élastique générés par l’oxydation dans l’épaisseur des plaquettes de 3 mm d’épaisseur de PEEK ont été déterminés par micro-indentation. À titre d’exemple, les profils obtenus avant et après 3166 h d’exposition dans l’air à 280 °C, et avant et après 645 h d’exposition dans l’air à 300 °C, sont rapportés sur la figure 24. On constate que le profil initial n’est pas tout à fait plat. En effet, le module élastique est légèrement plus faible en surface des échantillons en raison d’un taux de cristallinité plus faible (d’environ 30 %, contre 41 % au coeur), résultant du refroidissement inhomogène des échantillons (gradient de température dans l’épaisseur) après leur mise en forme par injection. Néanmoins, une valeur moyenne de module élastique EEchant a été calculée pour le PEEK non vieilli : elle vaut 5,0 ± 0,5 GPa. Cette valeur est légèrement supérieure à la valeur du module d’Young déterminée par traction uniaxiale sur des éprouvettes de type haltère : 4,2 ± 0,1 GPa. Pour cette raison, dans cette étude, un facteur correctif de 0,84 a été systématiquement appliqué au module d’indentation pour remonter à la valeur du module d’Young.
Au cours du vieillissement thermique, la micro-indentation met en évidence deux types distincts de comportement de part et d’autre de la température du pied du pic de fusion, c’est-à-dire de part et d’autre de Tf onset ≈ 290 °C (Fig. 25).
Lorsque T < 290 °C, le module d’Young augmente lentement dans toute l’épaisseur de l’échantillon (Fig. 24a). Cette augmentation est principalement attribuée au phénomène de recuit [26–30], même si le phénomène de chimicristallisation ne peut pas être complètement exclus. En effet, l’augmentation de la mobilité moléculaire favorise la cristallisation des chaînes macromoléculaires dans la phase amorphe situées au voisinage de germes ou de petits cristaux quasiment indétectables par DSC. Quoi qu’il en soit, le recuit se manifeste par l’apparition d’un pic de fusion secondaire centré environ 20 °C au-dessus de la température d’exposition sur les thermogrammes DSC. Ce pic se décale progressivement vers les hautes températures pour finalement s’intégrer au pic de fusion principal (Fig. 26a). Il en résulte une augmentation du taux global de cristallinité jusqu’à une valeur maximale de l’ordre de 50 % (Fig. 26b). Des analyses de diffraction des rayons X en temps réel (c’est-à-dire à la température d’exposition) permettraient certainement de mieux comprendre l’origine et la croissance de ces nouveaux cristaux.
Lorsque T > 290 °C, on observe une augmentation du module d’Young au coeur des échantillons, mais aussi une diminution du module d’Young dans la couche superficielle oxydée (Fig. 24b). Ici aussi, l’augmentation du module d’Young au cœur des échantillons est principalement attribuée au phénomène de recuit. En effet, à ces températures, les plus petits cristaux (c’est-à-dire les moins parfaits) fondent et ainsi, augmentent la fraction de phase amorphe susceptible de mieux cristalliser. On assiste alors à la disparition quasi-immédiate de la partie « basse température » du pic de fusion et, en contre-partie, à un soulèvement progressif de sa partie « haute température ». Il en résulte une augmentation du taux de cristallinité jusqu’à une valeur maximale de l’ordre de 50 %. Soulignons que, en l’absence d’oxygène, les coupures de chaîne se produisant au niveau des liaisons cétone et éther (Fig. 11) détruisent progressivement le réseau d’enchevêtrements dans la phase amorphe et ainsi, libérent de courts segments de chaîne qui vont pouvoir facilement migrer jusqu’à la surface des cristaux restant pour les intégrer [31–32]. De ce point de vue, les coupures de chaîne favorisent le recuit de la matrice PEEK.
En revanche, en présence d’oxygène, rappelons que la réticulation prédomine largement sur les coupures de chaîne. Au terme d’une période d’induction d’environ 100 h dans l’air à 300 °C (voir Fig. 17), la réticulation réduit considérablement la mobilité moléculaire dans la matrice PEEK et ainsi, s’oppose au phénomène recuit. Ainsi, le taux de cristallinité revient progressivement à sa valeur initiale (Fig. 27b).
Signalons que la diminution du module d’Young dans la couche oxydée se corrèle parfaitement avec les modifications de l’architecture macromoléculaire du PEEK, en particulier avec l’accumulation du benzoate de phényle déterminée par spectroscopie IRTF en mode ATR (Fig. 28).
Notons aussi que les épaisseurs de couche oxydée déterminées à l’aide de ces deux techniques (micro-indentation et spectroscopie IRTF) sont comparables. Elles sont du même ordre de grandeur que les épaisseurs de couche oxydée déterminées à l’aide d’une troisième technique : la microscopie optique. À titre d’exemple, la figure 29 présente des micrographies obtenues après quatre durées d’exposition dans l’air à 300 °C. On voit clairement que l’oxydation s’accompagne d’un changement de couleur (brunissement) en surface des échantillons.
Les épaisseurs moyennes de couche oxydée déterminées dans l’air à 280 et 300 °C à l’aide de ces trois techniques sont récapitulées dans le tableau 6.
Enfin, une corrélation a pu être établie entre le module d’Young et le taux de cristallinité. Les valeurs globales du module d’Young EEchant des plaquettes de PEEK vieillies dans l’air à 280 et 300 °C ont été calculées à l’aide de l’équation (6) à partir des profils de micro-indentation. Ces valeurs ont été portées en fonction du taux de cristallinité XC sur la figure 30, où elles sont comparées aux quelques données de traction uniaxiale disponibles dans la littérature [33,34]. On remarque que tous les points se placent autour d’une droite maîtresse unique d’équation :
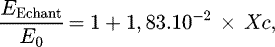 (11)
où E0 est le module d’Young de la phase amorphe du PEEK. Il vaut : E0 = 3 GPa en micro-indentation [17] et E0 = 2,5 GPa en traction uniaxiale [34].
(11)
où E0 est le module d’Young de la phase amorphe du PEEK. Il vaut : E0 = 3 GPa en micro-indentation [17] et E0 = 2,5 GPa en traction uniaxiale [34].
En fait, cette équation vérifie la relation de Tobolsky [35] :
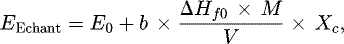 (12)
où M est la masse molaire et V le volume molaire du motif monomère, ΔHf0 est l’enthalpie de fusion du cristal et b est une constante.
(12)
où M est la masse molaire et V le volume molaire du motif monomère, ΔHf0 est l’enthalpie de fusion du cristal et b est une constante.
Rappelons que : M = 288 g.mol-1, V = 206 cm3.mol-1 et ΔHf0 = 130 J.g-1 pour le PEEK [16]. En égalisant les équations (11) et (12), il vient finalement : b = 25.
 |
Fig. 24 Profils de module d’Young dans l’épaisseur d’une plaquette de PEEK avant (en noir) et après (rouge) 3166 h d’exposition dans l’air à 280 °C (a) et 645 h d’exposition dans l’air à 300 °C (b). Profiles of the Young’s modulus in the thickness of the PEEK plate before (in black) and after (red) 3166 h of exposure in air at 280 °C (a) and 645 h of exposure in air at 300 °C (b). |
 |
Fig. 25 Thermogramme DSC du PEEK avant vieillissement. Positionnement des températures de vieillissement thermique de chaque côté du pied de l’endotherme de fusion. DSC thermogram of PEEK before ageing. Positioning of the thermal ageing temperatures on both sides of the onset of the melting endotherm. |
 |
Fig. 26 Modification du thermogramme DSC (a) et évolution du taux de cristallinité (b) au cours du vieillissement thermique des films de PEEK dans l’air à 280 °C. Modification of the DSC thermogram (a) and changes in the crystallinity ratio (b) during the thermal ageing of PEEK films in air at 280 °C. |
 |
Fig. 27 Modification du thermogramme DSC (a) et évolution du taux de cristallinité (b) au cours du vieillissement thermique des films de PEEK dans l’air à 300 °C. Modification of the DSC thermogram (a) and changes in the crystallinity ratio (b) during the thermal ageing of PEEK films in air at 300 °C. |
 |
Fig. 28 Comparaison des profils de dégradation déterminés dans l’épaisseur d’une plaquette de PEEK par spectroscopie IRTF ( Comparison of the degradation profiles determined in the thickness of a PEEK plate by FTIR spectrophotometry ( |
 |
Fig. 29 Observation au microscope optique (avec un grossissement × 2,5) de la couche superficielle oxydée du PEEK après différentes durées d’exposition dans l’air à 300 °C. Examination by optical microscopy (with a magnification of × 2,5) of the superficial oxidized layer of PEEK after different durations of exposure in air at 300 °C. |
Épaisseur moyenne de couche oxydée déterminée par micro-indentation, spectroscopie IRTF ou microscopie optique après différentes durées d’exposition du PEEK dans l’air à 280 et 300 °C.
Average thickness of oxidized layer of PEEK determined by micro-indentation, FTIR spectrophotometry or optical microscopy after different durations of exposure in air at 280 and 300 °C.
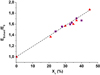 |
Fig. 30 Variation du module d’Young du PEEK (normalisé par le module de sa phase amorphe) avec le taux de cristallinité. Comparaison des valeurs déterminées par micro-indentation dans cette étude ( Changes in the Young’s modulus of PEEK (normalized by the Young’s modulus of its amosphous phase) with crystallinity ratio. Comparison of the values determined by micro-indentation in the present study ( |
4 Conclusion
La dégradation thermique de la matrice PEEK a été étudiée à l’état caoutchoutique entre 180 et 320 °C sous des pressions partielles d’oxygène comprises entre 0,21 et 50 bars, c’est-à-dire dans des domaines de température et de pression partielle d’oxygène presque complètement inexplorés. L’analyse à l’échelle moléculaire, par spectroscopie IRTF, a permis de d’identifier les principaux produits de dégradation s’accumulant dans la matrice PEEK et d’élucider en partie les mécanismes de thermolyse et de thermo-oxydation. Ces produits sont l’anhydride benzoïque (à 1780 cm-1), le benzoate de phényle (1740 cm-1), la fluorénone (1718 cm-1), les phénols (3650 cm-1) et l’acide benzoïque (3525 cm-1). L’anhydride benzoïque et le benzoate de phényle sont les deux produits majoritaires sous forte pression partielle d’oxygène. Ils proviennent de la terminaison par couplage des radicaux carboxyle et phénoxyle.
L’analyse aux échelles supérieures, par DSC puis par micro-indentation, a permis de montrer d’une part, que la réticulation prédomine largement sur les coupures de chaîne quelles que soient les conditions d’exposition. À l’état solide, un recuit s’opère dans toute l’épaisseur des échantillons, conduisant à une augmentation à la fois du taux de cristallinité et du module d’Young. En revanche, au-dessus du pied du pic de fusion, la réticulation réduit considérablement la mobilité moléculaire dans la couche oxydée où elle s’oppose au phénomène de recuit et ainsi, provoque la chûte du taux de cristallinité et du module d’Young. Dans tous les cas, les variations du module d’Young et du taux de cristallinité se corrèlent parfaitement et vérifient la relation de Tobolsky.
Dans une prochaine communication, un modèle cinétique sera dérivé du schéma mécanistique d’oxydation du PEEK pour être interfacé avec les relations structure/propriété identifiées dans cette étude (en particulier, avec les équations (9) et (12)). Cet outil théorique permettra de prédire non seulement l’état de dégradation du PEEK, mais aussi l’évolution de ses propriétés thermomécaniques au cours du vieillissement thermique. La validité de cet outil sera vérifiée à partir de l’ensemble des données expérimentales récoltées dans cette étude.
Références
- X. Colin, G. Teyssèdre, M. Fois, Ageing and degradation of multiphase polymer systems, in: A. Boudenne, L. Ibos, Y. Candau, S. Thomas (Eds.), Handbook of Multiphase Polymer Systems V 2/2, John Wiley & Sons Ltd, Chichester, 2011, pp. 797–841. [CrossRef] [Google Scholar]
- K.C. Cole, I.G. Casella, Fourier transform infrared spectroscopic study of thermal degradation in films of poly(etheretherketone), Thermochim. Acta. 211, 209 (1992) [CrossRef] [Google Scholar]
- M. Day, D. Sally, D.M. Wiles, Thermal degradation of poly(aryl-ether-ether-ketone): experimental evaluation of crosslinking reactions, J. Appl. Polym. Sci. 40(9–10), 1615 (1990) [CrossRef] [Google Scholar]
- J.N. Hay, D.J. Kemmish, Thermal decomposition of poly(aryl ether ketones), Polymer 28(12), 2047 (1987) [CrossRef] [Google Scholar]
- A. Jonas, R. Legras, Thermal stability and crystallization of poly(aryl ether ether ketone), Polymer 32(15), 2691 (1991) [CrossRef] [Google Scholar]
- P. Patel, T.R. Hull, R.W. McCabe, D. Flath, J. Grasmeder, M. Percy, Mechanism of thermal decomposition of poly(ether ether ketone) (PEEK) from a review of decomposition studies, Polym. Degrad. Stab. 95(5), 709 (2010) [CrossRef] [Google Scholar]
- C. Nicodeau, Modélisation du soudage en continu de composites à matrice thermoplastique, Thèse de doctorat, ENSAM, Paris, 2005 [Google Scholar]
- M. Day, T. Suprunchuk, J.D. Cooney, D.M. Wiles, Thermal degradation of poly(aryl-ether-ether-ketone) (PEEK): a differential scanning calorimetry study, J. Appl. Polym. Sci. 36(5), 1097 (1988) [CrossRef] [Google Scholar]
- K.L. White, L. Jin, N. Ferrer, M. Wong, T. Bremner, H.J. Sue, Rheological and thermal behaviors of commercial poly(aryletherketone)s, Polym. Eng. Sci. 53(3), 651 (2013) [CrossRef] [Google Scholar]
- E. Richaud, P. Ferreira, L. Audouin, X. Colin, J. Verdu, C. Monchy-Leroy, Radiochemical ageing of poly(ether ether ketone), Eur. Polym. J. 46(4), 731 (2010) [CrossRef] [Google Scholar]
- S. Giancaterina, A. Rossi, A. Rivaton, J.L. Gardette, Photochemical evolution of poly(ether ether ketone), Polym. Degrad. Stab. 68(1), 133 (2000) [CrossRef] [Google Scholar]
- S. Commereuc, D. Vaillant, J.L. Philippart, J. Lacoste, J. Lemaire, D.J. Carlsson, Photo and thermal decomposition of iPP hydroperoxides, Polym. Degrad. Stab. 57, 175 (1997) [CrossRef] [Google Scholar]
- D.J. Carlsson, R. Brousseau, D.M. Wiles, Reactions of sulfur dioxide with oxidized polyolefins, Polym. Degrad. Stab. 15, 67 (1986) [CrossRef] [Google Scholar]
- D.J. Carlsson, D.M. Wiles, The photodegradation of polypropylene films. II. photolysis of ketonic oxidation products, Macromolecules 2(6), 587 (1969) [CrossRef] [Google Scholar]
- F. Gugumus, Formation of ester functional groups in oxidizing polymers, Polym. Degrad. Stab. 65(1), 5 (1999) [CrossRef] [Google Scholar]
- D.J. Blundell, B.N. Osborn, The morphology of poly(aryl-ether-ether-ketone), Polymer 24(8), 953 (1983) [CrossRef] [Google Scholar]
- T. Iqbal, B.J. Briscoe, P.F. Luckham, Surface plasticization of poly(ether ether ketone), Eur. Polym. J. 47(12), 2244 (2011) [CrossRef] [Google Scholar]
- W.C. Oliver, G.M. Pharr, An improved technique for determining hardness and elastic modulus using load and displacement sensing indentation experiments, J. Mater. Res. 7(6), 1564 (1992) [NASA ADS] [CrossRef] [Google Scholar]
- S. Collin, P.-O. Bussière, S. Thérias, J.-M. Lambert, J. Perdereau, J.-L. Gardette, Physicochemical and mechanical impacts of photo-ageing on bisphenol a polycarbonate, Polym. Degrad. Stab. 97(11), 2284 (2012) [CrossRef] [Google Scholar]
- S.J. Blanksby, G.B. Ellison, Bond dissociation energies of organic molecules, Acc. Chem. Res. 36(4), 255 (2003) [CrossRef] [PubMed] [Google Scholar]
- L.K. Nait-Ali, X. Colin, A. Bergeret, Kinetic analysis and modelling of PET macromolecular changes during its mechanical recycling by extrusion, Polym. Degrad. Stab. 96(2), 236 (2011) [CrossRef] [Google Scholar]
- J. Pospíšil, Chemical and photochemical behaviour of phenolic antioxidants in polymer stabilization: a state of the art report, part II, Polym. Degrad. Stab. 39(1), 103 (1993) [CrossRef] [Google Scholar]
- X. Colin, L. Audouin, J. Verdu, Determination of thermal oxidation rate constants by an inverse method. Application to polyethylene, Polym. Degrad. Stab. 86(2), 309 (2004) [CrossRef] [Google Scholar]
- T.G. Fox, P.J. Flory, Second-order transition temperatures and related properties of polystyrene. I. Influence of molecular weight, J. Appl. Phys. 21(6), 581 (1950) [CrossRef] [Google Scholar]
- D.W.V. Krevelen, K.T. Nijenhuis, Properties of Polymers, vol. Fourth completely revised edition, Elsevier, Amsterdam, 2009 [Google Scholar]
- D.J. Blundell, On the interpretation of multiple melting peaks in poly(ether ether ketone), Polymer 28(13), 2248 (1987) [CrossRef] [Google Scholar]
- G.M.K. Ostberg, J.C. Seferis, Annealing effects on the crystallinity of polyetheretherketone (PEEK) and its carbon fiber composite, J. Appl. Polym. Sci. 33(1), 29 (1987) [CrossRef] [Google Scholar]
- D.C. Bassett, R.H. Olley, I.A.M. Al Raheil, On crystallization phenomena in PEEK, Polymer 29(10), 1745 (1988) [CrossRef] [Google Scholar]
- P. Cebe, Annealing study of poly(etheretherketone), J. Mater. Sci. 23(10), 3721 (1988) [CrossRef] [Google Scholar]
- M. Buggy, A. Carew, The effect of thermal ageing on carbon fibre-reinforced polyetheretherketone (PEEK) – Part II Morphological changes, J. Mater. Sci. 29(8), 2255 (1994) [CrossRef] [Google Scholar]
- M.S. Rabello, J.R. White, Crystallization and melting behaviour of photodegraded polypropylene – I. Chemi-crystallization, Polymer 38(26), 6379 (1997) [CrossRef] [Google Scholar]
- B. Fayolle, E. Richaud, X. Colin, J. Verdu, Review: degradation-induced embrittlement in semi-crystalline polymers having their amorphous phase in rubbery state, J. Mater. Sci. 43(22), 6999 (2008) [CrossRef] [Google Scholar]
- T. Nishino, K. Tada, K. Nakamae, Elastic modulus of crystalline regions of poly(ether ether ketone), poly(ether ketone) and poly(p-phenylene sulphide), Polymer 33(4), 736 (1992) [CrossRef] [Google Scholar]
- N.D. Albérola, P. Mélé, C. Bas, Tensile mechanical properties of PEEK films over a wide range of strain rates. II, J. Appl. Polym. Sci. 64(6), 1053 (1997) [CrossRef] [Google Scholar]
- A.V. Tobolsky, Properties and structure of polymers, Wiley, New York, 1960 [Google Scholar]
Citation de l’article : Emilie Courvoisier, Yoann Bicaba, Xavier Colin, Analyse de la dégradation thermique du Poly(éther éther cétone), Matériaux & Techniques 105, 403 (2017)
Liste des tableaux
Énergie d’activation des temps d’induction (ti) et des vitesses maximales (rox) de formation de l’anhydride benzoïque, du benzoate de phényle, de la fluorénone, des phénols et de l’acide benzoïque dans l’air entre 250 et 320 °C.
Activation energy of the induction times (ti) and the maximum rates (rox) of the formation of benzoic anhydride, phenyl benzoate, fluorenone, phenols and benzoic acid in air between 250 and 320 °C.
Énergie d’activation des vitesses maximales (rox) de formation du benzoate de phényle et de la fluorénone dans l’air à l’état caoutchoutique entre 250 et 320 °C (cette étude) et à l’état fondu entre 400 et 485 °C (littérature [2]).
Activation energy of the maximum rates (rox) of the formation of phenyl benzoate and fluorenone in air in rubbery state between 250 and 320 °C (present study) and in molten state between 400 and 485 °C (literature [2]).
Pression critique (Pc), temps d’induction (ti) et vitesse maximale (rox) de formation de l’anhydride benzoïque, du benzoate de phényle et de la fluorénone en excès d’oxygène à 220 et 250 °C.
Critical pressure (PC), induction time (ti) and maximum rate (rox) of the formation of benzoic anhydride, phenyl benzoate and fluorenone in oxygen excess at 220 and 250 °C.
Énergie d’activation du temps d’induction (ti) et de la vitesse maximale (r) des modifications moléculaires et macromoléculaires dans l’air entre 250 et 320 °C.
Activation energy of induction time (ti) and maximum rate (r) of molar and macromolecular modifications in air between 250 and 320 °C.
Pression critique (Pc), temps d’induction (ti) et vitesse maximale (r) des modifications moléculaires et macromoléculaires en excès d’oxygène à 250 °C.
Critical pressure (PC), induction time (ti) and maximum rate (r) of molar and macromolecular modifications in oxygen excess at 250 °C.
Épaisseur moyenne de couche oxydée déterminée par micro-indentation, spectroscopie IRTF ou microscopie optique après différentes durées d’exposition du PEEK dans l’air à 280 et 300 °C.
Average thickness of oxidized layer of PEEK determined by micro-indentation, FTIR spectrophotometry or optical microscopy after different durations of exposure in air at 280 and 300 °C.
Liste des figures
 |
Fig. 1 Modification des régions des liaisons C ═ O (a) et O–H (b) du spectre IRTF du PEEK au cours de son vieillissement thermique dans l’air à 300 °C. Changes in the regions of C ═ O (a) and O–H bonds (b) in the FTIR spectrum of PEEK during its thermal ageing in air at 300 °C. |
| Dans le texte | |
 |
Fig. 2 Déconvolution de la région des liaisons C ═ O du spectre IR du PEEK après 324 h d’exposition à 300 °C sous 0,21 bar d’oxygène (a) et après 196 h d’exposition à 250 °C sous 10 bars d’oxygène (b). Deconvolution of the region of C ═ O bonds in the IR spectrum of PEEK after 324 h of exposure at 300 °C under 0.21 bar of oxygen (a) and after 196 h of exposure at 250 °C under 10 bars of oxygen (b). |
| Dans le texte | |
 |
Fig. 3 Évolution des concentrations en anhydride benzoïque (a), benzoate de phényle (b) et fluorénone (c) au cours du vieillissement thermique du PEEK dans l’air à 250 (en vert), 280 (orange), 300 (rouge) et 320 °C (bleu). Changes in the concentrations of benzoic anhydride (a), phenyl benzoate (b) and fluorenone (c) during the thermal ageing of PEEK in air at 250 (in green), 280 (orange), 300 (red) and 320 °C (blue). |
| Dans le texte | |
 |
Fig. 4 Évolution des concentrations en phénols (a) et acide benzoïque (b) au cours du vieillissement thermique du PEEK dans l’air à 250 (en vert), 280 (orange), 300 (rouge) et 320 °C (bleu). Changes in the concentrations of phenols (a) and benzoic acid (b) during the thermal ageing of PEEK in air at 250 (in green), 280 (orange), 300 (red) and 320 °C (blue). |
| Dans le texte | |
 |
Fig. 5 Graphe d’Arrhenius des vitesse maximales (rox) de formation du benzoate de phényle (en bleu) et de la fluorénone (vert) dans l’air entre 250 et 485 °C. Les résultats de cette étude (entre 250 et 320 °C) sont en symboles pleins alors que ceux de la littérature (entre 400 et 485 °C [2]) sont en symboles vides. Arrhenius diagram of the maximum rates (rox) of the formation of phenyl benzoate (in blue) and fluorenone (green) in air between 250 and 485 °C. The results of the present study (between 250 and 320 °C) are given in full symbols whereas those of the literature (between 400 and 485 °C [2]) are given in empty symbols. |
| Dans le texte | |
 |
Fig. 6 Prédominance relative des bandes d’absorption IR du benzoate de phényle (à 1740 cm-1) et de la fluorénone (1718 cm-1) au cours du vieillissement thermique du PEEK dans l’air à l’état caoutchoutique entre 250 et 320 °C (cette étude) et à l’état fondu entre 400 et 485 °C (littérature [2]). Relative predominance of the IR absorption bands of phenyl benzoate (at 1740 cm-1) and fluorenone (1718 cm-1) during the thermal ageing of PEEK in air in rubbery state between 250 and 320 °C (present study) and in molten state between 400 and 485 °C (literature [2]). |
| Dans le texte | |
 |
Fig. 7 Mécanisme de formation du benzoate de phényle par couplage des radicaux carboxyle et phénoxyle. Formation mechanism of phenyl benzoate by coupling carboxyl and phenoxyl radicals. |
| Dans le texte | |
 |
Fig. 8 Évolution des concentrations en anhydride benzoïque (a), benzoate de phényle (b) et fluorénone (c) au cours du vieillissement thermique du PEEK sous une pression de 0,21 bar (en vert), 3 bars (rouge), 6 bars (violet), 8 bars (noir) et 10 bars d’oxygène (bleu) à 250 °C. Changes in the concentrations of benzoic anhydride (a), phenyl benzoate (b) and fluorenone (c) during the thermal ageing of PEEK under an oxygen pressure of 0.21 bar (in green), 3 bars (red), 6 bars (violet), 8 bars (black) and 10 bars (blue) at 250 °C. |
| Dans le texte | |
 |
Fig. 9 Évolution des concentrations en phénols (a) et acide benzoïque (b) au cours du vieillissement thermique du PEEK sous une pression de 0,21 bar (en vert), 3 bars (rouge), 6 bars (violet), 8 bars (noir) et 10 bars d’oxygène (bleu) à 250 °C. Changes in the concentrations of phenols (a) and benzoic acid (b) during the thermal ageing of PEEK under an oxygen pressure of 0.21 bar (in green), 3 bars (red), 6 bars (violet), 8 bars (black) and 10 bars (blue) at 250 °C. |
| Dans le texte | |
 |
Fig. 10 Variation des temps d’induction (a) et des vitesses maximales (b) de formation de l’anhydride benzoïque ( Changes of the induction times (a) and the maximum rates (b) of the formation of benzoic anhydride ( |
| Dans le texte | |
 |
Fig. 11 Amorçage de la dégradation thermique du PEEK par rupture thermolytique de liaisons cétone et éther de la chaîne macromoléculaire. Formation de plusieurs espèces radicalaires notées : P1●, P2●, P3● et P4●. Initiation of the thermal degradation of PEEK by thermolytic breakdown of ketone and ether bonds of the macromolecular chain. Formation of several radical species denoted: P1●, P2●, P3● and P4●. |
| Dans le texte | |
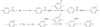 |
Fig. 12 Addition d’oxygène sur les radicaux acyle et phényle suivie de la formation d’hydroperoxydes par arrachement d’hydrogène sur les cycles aromatiques. Oxygen addition onto acyl and phenyl radicals followed by the formation of hydroperoxides by hydrogen abstraction on aromatic rings. |
| Dans le texte | |
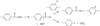 |
Fig. 13 Amorçage de la dégradation thermique par décomposition unimoléculaire de l’hydroperoxyde issu du radical acyle, entraînant la formation de l’acide benzoïque (en haut) ou une décarboxylation (en bas). Initiation of the thermal degradation by unimolecular decomposition of the hydroperoxide resulting from the acyl radical. Formation of benzoic acid (top) or decarboxylation (below). |
| Dans le texte | |
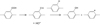 |
Fig. 14 Amorçage de la dégradation thermique par décomposition unimoléculaire de l’hydroperoxyde issu du radical phényle. Formation d’un phénol. Initiation of the thermal degradation by unimolecular decomposition of the hydroperoxide resulting from the phenyl radical. Formation of phenol. |
| Dans le texte | |
 |
Fig. 15 Mécanisme de formation de la fluorénone par couplage intramoléculaire des radicaux phényle. Formation mechanism of fluorenone by intramolecular coupling of phenyl radicals. |
| Dans le texte | |
 |
Fig. 16 Mécanisme de formation de la fluorénone par couplage intramoléculaire de radicaux peroxy. Formation mechanism of fluorenone by intramolecular coupling of peroxy radicals. |
| Dans le texte | |
 |
Fig. 17 Évolution des écarts entre la température de transition vitreuse et sa valeur initiale (Tg–Tg0) (a) et entre les nombres d’actes de réticulation et de coupure de chaîne (X–S) (b) au cours du vieillissement thermique du PEEK dans l’air à 250 (en vert), 280 (orange), 300 (rouge) et 320 °C (bleu). Changes in the gaps between the glass transition temperature and its initial value (Tg–Tg0) (a) and between the numbers of crosslinking and chain scission events (X–S) (b) during the thermal ageing of PEEK in air at 250 (in green), 280 (orange), 300 (red) and 320 °C (blue). |
| Dans le texte | |
 |
Fig. 18 Évolution des écarts entre la température de transition vitreuse et sa valeur initiale (Tg–Tg0) (a) et entre le nombre d’actes de réticulation et de coupure de chaîne (X–S) (b) au cours du vieillissement thermique du PEEK sous une pression de 0,21 bar (en vert), 3 bars (rouge), 8 bars (noir), 10 bars (bleu) et 20 bars d’oxygène (orange) à 250 °C. Changes in the gaps between the glass transition temperature and its initial value (Tg–Tg0) (a) and the number of crosslinking and chain scission events (X–S) (b) during the thermal ageing of PEEK under an oxygen pressure of 0.21 bar (in green), 3 bars (red), 8 bars (black), 10 bars (blue) and 20 bars (orange) at 250 °C. |
| Dans le texte | |
 |
Fig. 19 Variation du temps d’induction (a) et de la vitesse maximale (b) de réticulation avec la pression partielle d’oxygène à 250 °C. Changes in the induction time (a) and the maximum rate (b) of crosslinking with oxygen partial pressure at 250 °C. |
| Dans le texte | |
 |
Fig. 20 Mécanisme de réticulation du PEEK par couplage intermoléculaire des radicaux phényle [3–6]. Crosslinking mechanism of PEEK by intermolecular coupling of phenyl radicals [3–6]. |
| Dans le texte | |
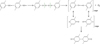 |
Fig. 21 Mécanisme de réticulation du PEEK par couplage intermoléculaire des radicaux péroxy. Crosslinking mechanism of PEEK by intermolecular coupling of peroxy radicals. |
| Dans le texte | |
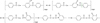 |
Fig. 22 Formation de l’anhydride benzoïque par couplage des radicaux carboxyle et phénoxyle. Formation of benzoic anhydride by coupling of carboxyl and phenoxyl radicals. |
| Dans le texte | |
 |
Fig. 23 Comparaison l’évolution des concentrations en anhydride benzoïque ( Comparison of the changes in the concentrations of benzoic anhydride ( |
| Dans le texte | |
 |
Fig. 24 Profils de module d’Young dans l’épaisseur d’une plaquette de PEEK avant (en noir) et après (rouge) 3166 h d’exposition dans l’air à 280 °C (a) et 645 h d’exposition dans l’air à 300 °C (b). Profiles of the Young’s modulus in the thickness of the PEEK plate before (in black) and after (red) 3166 h of exposure in air at 280 °C (a) and 645 h of exposure in air at 300 °C (b). |
| Dans le texte | |
 |
Fig. 25 Thermogramme DSC du PEEK avant vieillissement. Positionnement des températures de vieillissement thermique de chaque côté du pied de l’endotherme de fusion. DSC thermogram of PEEK before ageing. Positioning of the thermal ageing temperatures on both sides of the onset of the melting endotherm. |
| Dans le texte | |
 |
Fig. 26 Modification du thermogramme DSC (a) et évolution du taux de cristallinité (b) au cours du vieillissement thermique des films de PEEK dans l’air à 280 °C. Modification of the DSC thermogram (a) and changes in the crystallinity ratio (b) during the thermal ageing of PEEK films in air at 280 °C. |
| Dans le texte | |
 |
Fig. 27 Modification du thermogramme DSC (a) et évolution du taux de cristallinité (b) au cours du vieillissement thermique des films de PEEK dans l’air à 300 °C. Modification of the DSC thermogram (a) and changes in the crystallinity ratio (b) during the thermal ageing of PEEK films in air at 300 °C. |
| Dans le texte | |
 |
Fig. 28 Comparaison des profils de dégradation déterminés dans l’épaisseur d’une plaquette de PEEK par spectroscopie IRTF ( Comparison of the degradation profiles determined in the thickness of a PEEK plate by FTIR spectrophotometry ( |
| Dans le texte | |
 |
Fig. 29 Observation au microscope optique (avec un grossissement × 2,5) de la couche superficielle oxydée du PEEK après différentes durées d’exposition dans l’air à 300 °C. Examination by optical microscopy (with a magnification of × 2,5) of the superficial oxidized layer of PEEK after different durations of exposure in air at 300 °C. |
| Dans le texte | |
 |
Fig. 30 Variation du module d’Young du PEEK (normalisé par le module de sa phase amorphe) avec le taux de cristallinité. Comparaison des valeurs déterminées par micro-indentation dans cette étude ( Changes in the Young’s modulus of PEEK (normalized by the Young’s modulus of its amosphous phase) with crystallinity ratio. Comparison of the values determined by micro-indentation in the present study ( |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.





 ), du benzoate de phényle (
), du benzoate de phényle ( ) et de la fluorénone (
) et de la fluorénone ( ) avec la pression partielle d’oxygène à 250 °C.
) avec la pression partielle d’oxygène à 250 °C. ) et micro-indentation (
) et micro-indentation ( ) après 645 h d’exposition dans l’air à 300 °C.
) après 645 h d’exposition dans l’air à 300 °C. ).
).